A molécula de BeF2 e a explicação do orbital híbrido sp
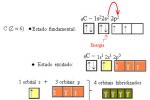
Considere a molécula de BeF2 (sabe-se experimentalmente que ela existe). O Berílio possui uma distribuição eletrônica de 1s² 2s² e portanto não existem elétrons desemparelhados disponíveis para as ligações. E agora?
Bom, sabemos que existem dois átomos ligados ao átomo central e não existem pares de elétrons não ligantes no mesmo. Portanto, temos uma geometria linear com ângulos de 180 graus. Sabemos também que um elétron de Be é compartilhado com cada um dos elétrons desemparelhados do F.
Seguindo o exemplo do carbono, poderíamos promover um elétron do orbital 2s no Be para o orbital
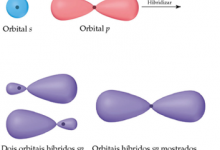
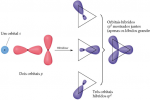
2p para obtermos dois elétrons desemparelhados para a ligação. Mas a geometria ainda não estaria explicada. Contudo, podemos solucionar o problema admitindo que o orbital 2s e um orbital 2p no Be misturam-se ou formam um orbital híbrido. Esse orbital híbrido é chamado de sp.
Observação: Já que somente um dos orbitais 2p do Be foi utilizado na hibridização, ainda existem dois orbitais p não-hibridizados no Be