A Hibridização do Carbono
Dando início ao assunto - Hibridização do Carbono:
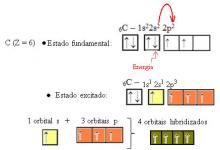
Vou dar uma colher de chá aqui. Para começar a entender o conceito, começaremos com o básico, ou seja, com o caso do carbono. Sabe-se que a única forma do carbono efetuar suas 4 ligações é por meio de seus elétrons (desemparelhados) em seus orbitais atômicos. Como assim? Bom, observe abaixo a distribuição eletrônica do carbono e sua distribuição nos orbitais.
É possível perceber que no orbital 2p, existem somente 2 elétrons desemparelhados (sozinhos) e um orbital totalmente vazio. Dessa forma, o carbono só poderia se ligar duas vezes. Mas não é isso que acontece.
A explicação para sua tetravalência se dá pelo fato de o átomo de carbono ter, antes da reação, um dos elétrons 2s promovido ao subnível 2p.
Agora sim! De acordo com a imagem acima agora temos 4 elétrons desemparelhados, devidamente aconchegados nos orbitais do carbono e esperando novos elétrons para efetuar as ligações. Para o caso da hibridização sp, temos a imagem abaixo:
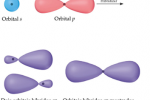
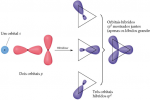
De forma análoga, a hibridização sp² e sp³ possuem respectivamente 1 e nenhum orbital "p" puro reservado para as ligações pi (ligações que servem para a aproximação de átomos já ligados através das ligações sigma).