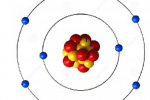
Modelo atômico de Rutherford
Ernest Rutherford realizou um experimento em que ele bombardeou uma finíssima lâmina de ouro com partículas alfa vindas do polônio radioativo. Ele observou que a maioria das partículas atravessava a folha, o que significava que o átomo deveria ter
imensos espaços vazios. Algumas partículas eram rebatidas, o que seria explicado se o átomo tivesse um núcleo pequeno e denso e, por fim, algumas partículas alfa sofriam um desvio em sua trajetória, o que significava que o núcleo seria positivo, pois
as partículas alfa eram positivas e foram repelidas ao passar perto do núcleo. Com isso, o modelo atômico de Rutherford defendeu o seguinte: O átomo seria composto por um núcleo muito pequeno e de carga elétrica positiva, que seria equilibrado por elétrons (partículas negativas), que ficavam girando ao redor do núcleo, numa região periférica denominada eletrosfera.
O átomo seria semelhante ao sistema solar, em que o núcleo representaria o Sol e os elétrons girando ao redor do núcleo seriam os planetas.