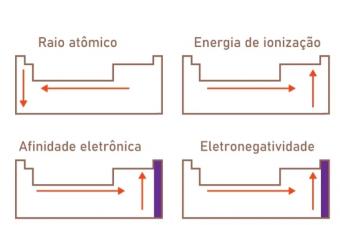
Propriedades periódicas
Configuração eletrônica: local de maior probabilidade de se encontrar os elétrons de um determinado átomo. Estando o átomo em estado neutro (sem carga), o número de elétrons será igual ao número de prótons, que é dado na tabela periódica. A informação sobre o número atômico fica disposta no lado superior esquerdo ao símbolo do elemento. A configuração eletrônica é feita a partir do número de elétrons de cada elemento e com o auxílio do diagrama de Linus Pauling, no qual os elétrons se organizam em camadas e subcamadas.
Raio atômico: varia conforme o número de elétrons que cada átomo comporta. Assim como na configuração eletrônica, o número de elétrons para átomos neutros é o mesmo que o número de prótons. O raio atômico é a distância entre o núcleo e o elétron da camada mais externa.
Eletronegatividade: é a predisposição que o átomo tem para atrair elétrons. Essa propriedade varia conforme a carga elétrica do átomo no estado fundamental e também pela proximidade da camada de valência com o núcleo do átomo.
Energia de ionização: é a energia necessária para a separação de um elétron do átomo. Conforme os elétrons vão sendo removidos, a energia de ionização vai aumentando. Essa energia varia conforme a distância do elétron a ser removido e o núcleo do átomo, pois o núcleo exerce atração e energia potencial elétrica, duas forças que dificultam a retirada do elétron.
Afinidade eletrônica ou eletroafinidade: é a energia liberada quando o átomo se adere a um elétron externo. Mede a força de atração que o átomo tem para capturar elétrons e se tornar um íon de carga negativa.