Ligação de Hidrogênio
polo positivo é sempre o hidrogênio, e o polo negativo pode ser o flúor, o oxigênio ou o nitrogênio, pois esses elementos são bastante eletronegativos, ou seja, atraem mais fortemente os elétrons da ligação dupla e ficam com carga parcial negativa.
Alguns textos mais antigos usam a denominação “pontes de hidrogênio”, mas esse termo está ultrapassado e o correto é ligação de hidrogênio.
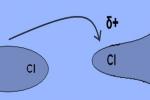
Por exemplo, consideremos as moléculas do fluoreto de hidrogênio (HF), uma molécula polar. No estado sólido, as suas moléculas atraem-se, de modo que o polo positivo (hidrogênio) de uma molécula atrai o polo negativo (flúor) de outra:
Ligações de hidrogênio entre moléculas de fluoreto de hidrogênio
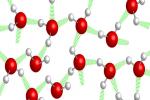
As moléculas de água também realizam esse tipo de interação intermolecular com suas próprias moléculas e com moléculas de outras substâncias que se dissolvem nela. As moléculas de H2O são polares, pois os hidrogênios possuem carga parcial positiva (δ+), e o oxigênio possui carga parcial negativa (δ-). Assim, o hidrogênio de uma molécula é atraído pelo oxigênio de outra molécula.
No estado líquido, esse tipo de interação ocorre em todos os sentidos (com moléculas ao lado, acima e abaixo).
Ligações de hidrogênio na água líquida
Essa interação resulta em algumas propriedades interessantes da água, como a formação da tensão superficial, ou seja, uma espécie de membrana elástica ou película que se forma em sua superfície. Isso ocorre porque as moléculas de água da superfície realizam as ligações de hidrogênio somente com moléculas que ficam abaixo e ao lado, sendo, dessa forma, atraídas para o interior do líquido, pois não há moléculas acima delas para atraí-las também. Esse processo é responsável pela formação da película mencionada na superfície do líquido.
Essa tensão superficial da água é tão intensa que permite que alguns insetos caminhem sobre ela, além de ser de extrema importância para certas comunidades, tais como de bactérias, fungos, algas, larvas e crustáceos, pois permite a sobrevivência delas em superfícies de lagos.
Inseto andando sobre a água em virtude da elevada tensão superficial
No estado líquido, as moléculas estão mais afastadas umas das outras, apresentando certo grau de liberdade de movimentação, por isso as ligações de hidrogênio entre suas moléculas estão o tempo todo sendo feitas e desfeitas. Por outro lado, no estado sólido, as moléculas de H2O estão mais próximas e realizam ligações de hidrogênio, formando estruturas hexagonais, como a mostrada abaixo. Esses espaços vazios que ficam entre as moléculas diminuem a densidade do gelo, pois fazem com que o seu volume aumente.
Ligações de hidrogênio entre moléculas de água no gelo
Essa é outra propriedade importante, pois visto que o gelo fica menos denso, ele flutua sobre as superfícies de rios, lagos, mares e oceanos, atuando como um isolante térmico natural que mantém a água abaixo dele no estado líquido, o que mantém vários animais aquáticos vivos.
Mas, conforme dito, as ligações de hidrogênio também podem ocorrer em misturas entre moléculas de substâncias diferentes. Por exemplo, quando se adiciona determinado volume de álcool em certo volume de água, pode-se observar que o volume final da mistura desses dois líquidos é sempre menor que a soma deles e que o álcool é infinitamente solúvel em água.
Isso ocorre porque o álcool é o etanol (H3C — CH2 — OH), então, sua molécula possui a extremidade polar, em razão da presença do grupo hidroxila, OH. Desse modo, o hidrogênio das moléculas de água é atraído pelo oxigênio das moléculas do etanol, realizando ligações de hidrogênio. É por isso que o volume contrai e o álcool é solúvel em água.